Table of Contents
BioLab Brussels Research
research:
1. Algae Generator
Close monitoring of the photosynthesis process by Cyanobacteria.
Grow different algae strains and monitor with a DIY build PBR (photobioreactor).
2. Pollution Monitoring with Lichens
Lichen, symbiont of fungi and algae or Cyanobacteria. Grows on wood, soil, rocks. Survives in extreme conditions. Synthetic biology on the Cyanobacteria (Nostoc?)to make them change color.
3. Distillation process: the smell of the Hive.
Distillation of dead bees, wax, propolis and honey of a specific beehive, to reconstruct the personalised smell of a specific beehive.
artistic output:
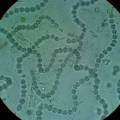
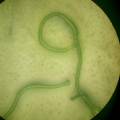
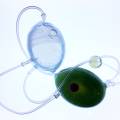
1. anabaena chain in glass Anabaena chain
2. output in several small experiments, small sculptures, petridishes, … DIY bio-experiments
3. perfume: the smell of the hive
20/8/2019
Check logistics bioLab met Stefanie en Tom.
Destillatieproces opzetten met Pieter, eerste aanzet voor het extraheren van de vluchtige geurstoffen van de verschillende componenten uit de beehive: bijenwas, honing, propolis, pollen en dode bijen.
21/8/2019
Meegebracht naar lab:
- purple bacteria (Rhodospirillum rubrum, Rhodoblaster acidophylium, Rhodoblaster spheraides)
- petridishes met ceramic, epoxy en plaster castings
Gestart met het maken van groeimedium voor Purple bacteria volgens onderstaand recept:
dsmz_medium27_rhodospirullum_rubrum.pdf
- alle ingredieënten voor destillatie 'smell of the hive' (dead bees, pollen, propolis, wax, honing)
- de Cyanobacteria besteld bij Carolina Sciences: Anabaena, Mycocystis, Spirogyra, Nostoc, Oscillatoria.
We beginnen met het proces om vluchtige stoffen te extraheren uit de verschillende ingrediënten verzameld in augustus 2019 in de Beehive II (Urban BeeLab Brussel):
- pollen: in vijzel tot poeder malen. Sticky. Eerst oven-drogen en dan harde pellet in vijzel fijnstampen.
Extractionanddeterminationofbioactivecompoundsfrombeepollen
- dead bees: in droogoven en dan tot poeder malen.
- propolis:
- wax:
- honing:
22/08/2019
Groeimedium Purple bacteria afgewerkt, geautoclaveerd en bacteria geinoculeerd in de flow (Rhodospirillum en Rhodobacter) in erlenmeyer flasks. TL met timer geïnstalleerd, nog geen luchtpomp.
Medium voor Rhodoblastus acidophilus afgewerkt, geautoclaveerd en geïnoculeerd in Erlenmeyer.
Soil-water medium gemaakt met aarde uit Laarbeek bos, gesteamd, voor Spirogyra bacteria
Alga-gro fresh water medium voor Cyanobacteria.
4 x geïnoculeerd met fresh water.
Op trilplaat onder cool fluorescent light met timer
7 tot 10 dagen in beweging onder TL light van 7am tot 9pm (Circadian Cycle)
23/08/2019
Destillatie 'Smell of the Hive': hydro-destillaat van dead bees.
Destillatie 'Smell of the Hive': hydro-destillaat van propolis.
26/08/2019
27/08/2019
Honing: Solventextractie in Chloroform met scheitrechter methode
100gr honing
150ml water
50ml chloroform
Honing (2de poging): Ultrasound solvent extraction (USE)
Ultrasound solvent extraction was performed as described previously with some modification [18, 19]. Twenty grams of ivy honey was placed in a 100 ml flask and dissolved in 12 ml of distilled water followed by the addition of 0.80 g of anhydrous magnesium sulfate. The aqueous solutions were then extracted with 10 ml of dichloromethane using an ultrasonic cleaning bath (Cole-Parmer 8891) at 25 °C for 30 min. After sonication, the whole extract was centrifuged at 3000 rpm, and the organic layer was collected. Each sample was extracted three times with a new portion of the solvent. The organic layers were combined, dried over anhydrous magnesium sulfate and concentrated under a nitrogen gas stream. The procedure was performed in triplicate with the same amount of honey. The resulting oily residues were dissolved in 350 µl of dichloromethane and stored at 4 °C until HPTLC and GC–MS analysis.
In centrifuge aan 3000rpm voor 5 minuten
03/09/2019
Soil-water solution: 5mg soil on 1ml water; = 3,75gr soil on 750ml water.
Daarna agar platen maken hiervan voor het groeien van de Spirogyra en de Synechocystis op vast medium.
Cyanobacteria op cultuur gezet voor vermeerdering op korte termijn.
980ml gedistilleerd (en geautoclaveerd) water met 20ml BG11 en geïnoculeerd met de rest van de Cyanobacteria proefbuisjes.
Katrien Jacobs geconsulteerd ivm. versterken van de gedistilleerde geuren.
Volgene vrijdag doen we een Vigroux destillatie met het verkregen materiaal uit de 1ste destillatie, voor dode bijen, pollen, was en propolis.
De honing zullen we aanlengen met een niet riekende organische stof (TBD).
13/09/2019
Agarplaten met BG11 voor lange termijn bewaren van Cyanobacteria
490ml gedistilleerd water met 4g agarose
autoclaveren
mengen met 10ml BG11 in de flow
platen gieten en inoculeren
De agarose plaatjes die geënt waren met Cyanobacteria bekeken onder de microskoop. De bacteria beginnen te groeien op de agar.
2de destillatie van 'Dead Bees' en van 'BeesWax'. Brengt niet zoveel sterkere geur voort, alhoewel het water dat na de hydro destillatie in het potje (rechts) komt wel quasi reukloos is, dus dat er eigenlijk toch meer stoffen zouden moeten zitten in de originele recipient (links).
Presentatie 'Smell of the Hive' in kleine ronde kolfjes.
Propolis en Pollen destillaat genomen van de eerste destillatie.
BG11 meegenomen naar studio thuis voor DIY experimenten. Gebruik vanaf nu BG11 voor de Synechocystis en Spirogyra culturen, dit geeft veel beter resultaat dan het zelfgemaakte soil-water medium.
Subcultuur Synechocystis opgezet en cultuur in grote aquarium aangevuld met BG11.
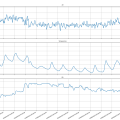
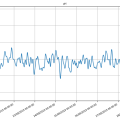
Bioreactor data: 21/10/2019 (periode 12 sept.2019 tot 4 okt.2019, 4 laatste fotoos)
De losse pngs geven iets duidelijker het verloop aan (hogere dus meer resolutie).
⇒
Wat OD betreft, dit is een vector die bestaat uit de 3 rgb metingen en de bijhorende weerstand.
vMax = ³√(3*1024^2) = 1024 (maximale waarde die gemeten kan worden: vloeistof is transparant)
vMet = ³√(r^2+g^2+b^2) (de gemeten waarde)
od = 100 - ( vMet / ( vMmax / 100 ) ) (herleid naar procenten, we draaien het percentage om omdat we de dichtheid meten en niet de transparantie)
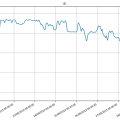
Bioreactor data: 23/12/2019 tot 6/1/2020 (eerste foto)
Eerste graph dd. 23/12 tot 6/1⇒ de cyanobacteria zijn niet gelukkig, hun ontwikkeling zakt zienderogen naar beneden. Reden is dat de verwarming uitstond tijdens de Kerstperiode. Men kan zien dat van 23 tot 27 er nog een normale temperatuur was van ongeveer 21°C. Vanaf 28 gaat de temperatuur over 3 dagen naar 10°C en zowel de pH als de OD volgens deze daling.pH zakt van 7.30 naar 6.25, terwijl de relatieve OD zakt van 20 naar 10. Ook waren de transparante buisjes redelijk 'geclogt' met aaneengekookte bacteria.
Een voor de bacteria aangename temperatuur (minimum van 21°C maar beter nog hoger, tot 25°C) is dus noodzakelijk voor een goede ontwikkeling!
17/09/2019
2 van de 3 Purple Bacteria culturen zijn gecontamineerd. De Rhodospirillum rubrum doet het nog goed.
Mycocystis cultuur op BG11 (Erlenmeyer) groeit niet goed. Vervangen door nieuwe cultuur Mycocystis op Alga Gro Freshwater.
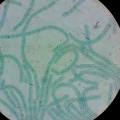
Cyanobacteria vermeerderen op agarose+BG11 ⇒ Experiment om alle 4 cyanobacteria (Nostoc, Mycocystis, Oscillatoria en Anabaena) te laten groeien IN de agarose ipv. bovenop de agarose ⇒ dit is een test voor mijn project Anabaena bacteria ketting. Als het experiment lukt, dan kunnen de cyanobacteria over het verloop van de tentoonstelling vermeerderen in de agar+BG11, ipv. in liquide growmedium. Dit maakt de ketting handelbaarder.
Plan opgemaakt voor aanzet onderzoek lichen/cyanobacteria pollution sensor:
'I am still working on the pollution sensor, also in the Open BioLab in Brussels, but I approach this more from the biotechnical side (synthetic biology) than from the engineering biotech side. I am growing several kinds of Cyanobacteria and I am also experimenting with growing lichen and combining several Photobiont organisms in order to find out which ones can survive in West European outside conditions.'
nostoc_lichen.pdf
lichen Photobionts
⇒ biosensor met visuele verandering, waarneming van de pollutie
bv. stikstofoxyde detecteren in gepollueerde lucht
01/10/2019
Evaluatie algen: Mycocystis groeit goed in Alga-Gro maar niet in BG11.
Anabaena maakt bruine vlokken aan. Dit zijn cellen die de stikstof uit de lucht fixeren en omzetten in nitraten. In Alga-Gro zit al stikstof, dus daar moeten ze het zelf niet aanmaken en daar zijn dus ook geen bruine cellen. In BG11 zit geen nitraat en daar moeten ze het zelf aanmaken en zijn er dus cellen die deze functie op zich gaan nemen. De morfologie van deze cellen is ook anders dan van de andere cellen.
Oscillatoria maken een biofilm aan in liquide groeimedium. In de agarose verspreidt Oscillatoria mooi door het medium. Agarose is dus misschien een goed materiaal om als hydrogel te gebruiken in de bacteria ketting.
Spectrophotometrie op rode en groene algen, + op Synechocystis.
Eerst materiaal centrifugeren voor 5 minuten aan 3000 rpm
08/10/2019
harvested biofilms
Informatie over cyanobacteria & synthetic biology: given by Prof. Annick Wilmotte awilmotte@uliege.be
Note that as a culture collection, we are always interested by outreach activities with artists. We are also member of the Belgian Consortium of culture collections (BCCM) including bacteria and fungi. So, if Ms Maes was ever interested, I am sure that the BCCM collections would be eager to collaborate, provide material, etc…
For cyanobacteria & synthetic biology, I advise to contact Prof. Tamagnini, Porto University (pmtamagn@ibmc.up.pt) :https://www.i3s.up.pt/research-group?x=5
18/10/2019
first skins tests with different mediums: phytagel, gelatine, agaroase+BG11
make Phytagel
make Gelatine
22/10/2019
Monitor skin tests
Allen's blue-green medium maken
Make bacterial cellulose hydrophobe: how? (eg. amino acids of orange peel)
Start tests with Cyanobacteria and Fungi or Plants as a symbiontic pollutionsensor
Observations:
Non-sterilased green and red algae in gelatin is contaminated.
Anabaena in BG11 and agarose is contaminated.
Microcystis in agarose from 17.09.19 is contaminated.
Non-sterilised algea in phtogel is not contaminated.
All the skins sink in the bottom of the petri dish.
Cyanobacterias grown with BG11 gives brown spots on the plates because of the absence of nitrate.
Gelatin makes contamination because it has too much nutrients inside it.
Agarose with alga gro is the most suitable one.
Nostoc in agarose did not grow around or on skin because the skin was too acidic. Thus, we decided to neutralize the skin with sodium carbonate (Na2CO3.H20)and prepared new growth plates with this neutralized skin.
Practice:
New plates will be prepared with neutralized skin and 4 different cyanobacteria in agarose and alga gro.
1) pH of distilled water is measured —> 6.88
(The pH of distilled water slowly continued to decrease because it absorbed the acidity of the skin from the air.)
pH of Sodium carbonate is measured —> 10.50
When we put the skin inside the sodium carbonate solution, the pH of the skin stay close to 10. So we rinse the skin and keep it in the distilled water with a small amount of sodium carbonate.
The pH of the skin is neutralized —> 7.06
2) %0.8 agarose medium is prepared —> 500 ml alga gro + 4 gr agarose
3) Neutralized skin and agarose medium is autoclaved.
4) 2 petri dishes for each cyanobacteria is prepared. (Microcystis, Nostoc, Anabaena, Oscillatoria)
- —→ For each petri dish: 20ml % 0.8 Agarose medium, 2ml cyanobacteria and piece of skin
The skins were thicker than the ones we used in the previous lab session.
Microscobic Observations:
We took sections from the old samples.
anabaena/ agarose BG11 —→ cyanobacteria inside the yeast cluster is observed.
nostoc / BG11 —→ nostoc and fungi together is observed.
24-30/10/2019 Amsterdam Hybrid Forms lab
Tests with agarose/cyanobacteria batteries, Copper and aluminium. Agarose is conductive. Bacterial cellulose skin is acid medium. We measure voltage with 3 batteries in series. With and without microbial skins.
We collect all ingredient to make homemade BG11 (for Synechocystis). Cfr. the recipes online from DSMZ, for all cyanobacteria. Use K2HPO4 (Dipotassium phosphate) and/or Na2CO3 (Sodium carbonate) as buffers to adjust the pH of the BG11.
We also collect all ingredients to make Zarouk medium for the Spirulina. + traces for all cultures: Spirulina, Synechocystis and the 3 purple bacteria.
Use halogen light instead of fluorescent light to illuminate the Cyanobacteria. Halogen light is near infrared from wavelength, and Cyanobacteria prefer waves from 700/800nm (red) or from 300/400nm (green/blue).
05/11/2019
Ik zal droge skin meebrengen (en er ligt er al 1 in het lab) om te testen met de nieuwe informatie over mogelijke coating met azijnzuur. Ik heb vanuit het lab in Amsterdam ook alle ingredienten mee voor : 1. medium Spirulina, 2. medium BG11 en 3. traces voor de purple bacteria.
Ik vroeg me af of er misschien bepaalde schimmels zijn die ev. als coating voor de microbial skins zouden kunnen gebruikt worden. Schimmels die groeien óp de skins zelf. Ik ben op het lab geweest vorige vrijdag en ik zag dat op bijna alle geneutraliseerde stukjes skin schimmel gegroeid is - al weet ik niet welke schimmel het is. Het is weeral witte, misschien is die schimmel eerder gerelateerd aan de cyanobacteria dan aan de microbial skins? Of aan de combinatie van beiden, want de cyanobacteria op zichzelf gaven toch geen (of zeer weinig) schimmel bij groei in de petridish …
Methylcellulose: https://www.carlroth.com/be/nl/Chemicali%C3%ABn/A-Z-Chemicals/M/Methylcellulose/Methylcellulose/p/000000010000270400020023_nl
Sodium Alginate: https://www.carlroth.com/be/nl/Chemicali%C3%ABn/A-Z-Chemicals/N/Sodium-alginate/p/0000000200022dcc00010023_nl (bestellen???)
5/11/2019: In biolab: Agarose (5,5gr/1000ml - toch iets meer agarose gebruiken?) + 20ml/l Alga Grow medium aangelengd met kraanwater (autoclaved) + adjusted buffer tot 7.8pH. Na autoclaveren wordt de agarose + kraanwater BRUIN/rose!!!. Geïnoculeerd met NOSTOC cyanobacteria. In glascell Venezia.
Ook op 5/11/19: Vanaf petriplaten met Anabaena en Oscillatoria een liquide cultuur gemaakt in Alga Grow + geautoclaved kraanwater met adjusted buffer. De algenculturen die we aanlengden met Alga Grow+kraanwater doen heel raar na 1 week: er zitten overal witte slierten in … Dit komt waarschijnlijk van het kraanwater! Ben benieuwd of dit ook zo is bij de samples op het lab. Zou moeten, want is met zelfde water gemaakt.
Nieuwe cultuur gemaakt met Anabaena (nieuwe batch van Carolina) en geautoclaved kraanwater met adjusted buffer.
Nieuwe cultuur gemaakt van Synechocystis met gedemineraliseerd water en BG11.
Op 6/11/19 (thuis): 2 glazen cellen uit Venezia gevuld.
Cel 1: gelling agent: Phytagel + demi water. Nutrient: BG11. Bacteria: Oscillatoria (uit stock 1 Carolina).
Cel 2: gelling agent: agarose (1,3gr voor 250ml demi water). Nutrient: Alga Grow (5ml bijgevoegd ná autoclaveren van de agarose met demi water). Bacteria: Anabaena (uit stock 1 Carolina).
Na 5 dagen: Agarose met Anabaena is nog OK (maar veel te weinig Anabaena). Op Phytagel medium groeit schimmel. De glzen cel in de microgolf gestoken en medium opgelost. Cel uitgekuist maar niet gesterelizeerd.
Cel terug gevuld met: ± 400ml Agarose medium (8gr/1000ml demiwater) met BG11 (20ml/980ml) en demi water. Zeker 25ml Synechocystis geconcentreerd bijgevoegd.
19/11/2019
Medium gemaakt voor Janthinobacterium lividum.
1. Agar-versie met LB, voor 500ml (totaal) ⇒ om petri platen te gieten
- 20g LB agar
- 10g glycerine
- 470ml demi water
2. liquide medium, voor 500ml (totaal) ⇒ om te gebruiken op textiel of andere
- 500ml demi water
- 12,5g LB broth
- 10g glycerine
https://en.wikipedia.org/wiki/Janthinobacterium_lividum
Observations:
- Anabaena and oscillatioria (new liquid samples) made by tap water are contaminated.
- Old liquid samples are also contaminated.
- Nostoc in petridish are in good condition and growed close to the neutralised skin.
- Microcystis + neutralized skin is also contaminated.
- Glass cells: Anabaena inside the glass cell is contaminated (tap water).
- When Agarose gelified in glass cells, it became opaque white. It needs more cyanobacteria growth to become green or maybe change the medium to phyto gel.
- 5.5 gr agarose/L is not enough. It should be increased.
Method:
- New samples of Anabaena, Oscillatoria and Microcystis will be grown.
- Spiriluna will be grown.
- Janthinobacterium lividum medium will be prepared.
- New glass cells with Anabeana and Microcystis will be prepared.
Medium Alga-Gro preparation for Anabaena, Microcystis and Oscillatoria
Solid Medium (for refilling the glass cells):
- 1lt agarose medium is prepared in two 0.5lt bottles.(0,85% = 8,5gr/l)
- 4.3gr agarose + 10 ml alga gro + 490 ml distilled water for each 0.5lt bottle.
Liquid Medium:
- 490ml distilled water + 10 ml alga gro in 0.5lt bottle.
- pH of the mediums are measured —–> ph=6.6
- The mediums are buffered with NaOH (Natrium)/Sodium Hydroxide up to 7.8↔8 (More or less 10 drops of NaOH)
4 falcon tubes are prepared. 2 for anabeana, 2 for oscillatoria ⇒
- Anabaena –> 2 Falcon tubes: one of 35ml and one of 20ml (alga gro) + Anabaena bacteria taken from a non-contaminated solid medium (petri dish)
- Oscillatoria –> 2 Falcon tubes: one of 35 ml and one of 20 ml (alga gro) + Oscillatoria taken from solid medium (petri dish)
- Two 100ml Microscystis from stock (liquid) are prepared in flasks. 75ml buffered alga-gro + 25 ml Microcystis from 17.9.19 stock.
Glass Cells
- Anabaena and Oscillatoria are centrifuged at 2000rpm for 2 minutes in 50ml falcon tubes.
- (Oscillatoria is clustered after the centrifuge, not enough amount even after the centrifuge).
- Microcystis is centrifuged 2+10+15 minutes at 2000rpm in 50 ml falcon tubes.
- 325ml agarose medium is put for each cell.
- cell 1—> 325ml medium + 11ml contaminated/concentrated Anabeana.
- cell 2—> 325ml medium + (±) 20ml concentrated Microcystis.
Spiriluna
2 flasks are prepared—> 8ml Spiriluna bacteria + 130ml Zarrouk medium for each flask.
Janthinobacterium Lividum
- Solid and Liquid LB mediums are prepared.
- LB Agar (solid)⇒ 20gr agar + 10 gr glycerol + 470 ml demiwater
- Broth LB (Liquid)⇒ 12,5 gr LB 470ml demiwater
- microwave
- autoclave
- LB agar is put in the incubator at 50C° not to be solidified until next week, when we will pour the plates.
26/11/2019
Janthinobacterium lividum. Bought dry frozen cells at BCCM Ghent.
How to open a BCCM/LMG ampoule, in this case dry-frozen Janthinobacterium lividum.
https://www.youtube.com/watch?v=Kc5Q5GNjVYI
Made 2 petridish and 2 test tubes with J. lividum, the liquid in LB broth + 2% glycerine and the plates with LB agar + 2% glycerine.
Make the medium for the Rhodobacter bacteria (traces material from Amsterdam, other components from Open BioLab). Make 2 different mediums, 1 for Rhodospirillum rubrum and the other one for …
How to make a bacterial cellulose skin hydrophobic?
protocol for acetylation of bacterial cellulose
⇒ seems that the second protocol is the most suitable.
Skin becomes totally white, but at the end of the protocol it seems stronger than before.
Will dry them and see what is the result in texture and if the cellulose fabric is really (more) hydrophobic.
Er is weeral probleem met de bacteria/agarose die we dinsdag gemaakt hebben in de cellen. Agarose wordt witter en de kleur van de bacteria verdwijnt, toch tgo. de beginkleur. We moeten zeker nog eens een steriele test doen met Pgytagel, maar ik heb geen glazen cellen meer. We moeten een gelijkaardig rond recipient vinden waar we een 350ml massa gelling agent in kunnen doen.
Misschien moeten we eens testen met die mengeling van agar/phytagel die we in de kast gevonden hebben. Maar ik denk ook dat volume van de cellen te groot is misschien. En ik kan dat niet meer veranderen want ze zijn al in productie. Misschien eens info opzoeken over stolling van de agar of agarose of phytagel. Of er een ideale temperatuur is die barsten voorkomt? Ik denk dat de barsten misschien veroorzaakt worden doordat de agarose terug opgewarmd is in de microgolf, nadat ze eerst al gestold was … verandering in de structuur van de moleculen?
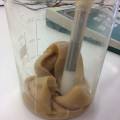
Foto 1: Vers gevulde cellen op 21/11/2019, met Microcystis en Anabaena, Open BioLab. Foto 3: gebarsten medium in glass cell gevuld met Synechocystis en agarose+BG11. Komt dit doordat de agarose gestold en in de microgolf terug vloeibaar gemaakt was? Verandering van stuctuur van de moleculen? Foto4: het medium dat op foto 1 nog bright green is, 3 dagen later, nadat de agarose gestold is. Het lijkt alsof de cyanobacteria hun pigment verdwijnt. Foto 2: nieuwe vulling met Phytagel & Synechocystis
Method:
The medium for rhodospirillaceae will be made
The bacterial skin will be made hydrophobic by
Janthinobacterium vividum will be cultivated on the medium prepared last week.
Acetylation:
- 600 ml %1 NaOH is prepared form 1mol/tl solution. (450 ml distilled water, 150 ml NaOH)
- The skins are put inside the solution and heated up to 80degrees.
- The skins get very transparent and thin after with NaOH. The 2. Protocol mentions about 1cm thickness of skin, whereas 1. Protocol does not give information about it.
- For protocol 1. We put to piece of skin on top of eachother (one healthy, one destroyed) and put to the oven to dry at 80 degrees for 2 hours.
We continued with protocol 2.
- The remaining pieces soaked to anhydrous acedic acid, squeezed and soaked again 3 Times.
- Then the skin samples are placed to a solution consists of 20ml acedic acid, 25ml toluene, and 85,7microliter %70 perchloric acid. The mixture is shaked vigorously.
- 10ml acedic anhydride is added to the mixture and shaked for 1 minute vigorously again.
- The mixture waited on the room tempreture for an hour.
- Then, the samples are squeezed and washed with methanol, then distilled water, and let it dry.
Cultivation of Janthinobacterium vividum:
The bacterias are cultivated both 2 liquid medium and 2 solid medium which are already prepared last week.
Preparation of Rhodospirillaceae Medium:
Protocol DSMZ 26———> 0.2gr/L yeast extract
Protocol DSMZ 27———> 0.3gr/L yeast extract
500ml from each protocol is be prepared.
B12 solution from Cyanobalabinum is prepared. (10 mg in 100ml distilled water)
Fe(III) citrate solution is prepared. (0.1% in H20 ———> 100mg in 100ml distilled water) and heated to 60degree on the hot plate to dissolve.
0.2gr/L yeast extract is prepared.
All the ingredients below are added to the mixture:
- Yeast extract 0.2gr
- Na2-succinate 0.729gr
- NH4-acetate 0.5gr
- KH2PO4 0.5gr
- MgSO4 x 7H2O 0.4gr
- NaCl 0.40gr
- CaCl2 x 2H2O 0.05gr
- Trace element solution SL-6 1ml
- L-Cysteiniumchloride 0.231gr
- Vitamin B12 solution 0.40ml
- Fe(III) citrate solution 5ml (we put it last because it is light sensitive.)
- 990ml distilled
1000ml medium solution separeted in two 500ml battle. 0.05gr yeast extract is added to One of the bottles according to protocol 27. Two bottles are put to the microwave to dissolve.
The pH of the mediums are measured:
Protokol 26 medium——> pH4.32
- Titrated with low concentration (1mol) and high concentration (%29-30) NaOH
- After titration———> pH5.7
Protokol 27 medium———> pH4.36
- * Titrated with low concentration (1mol) and high concentration (%29-30) NaOH
- After titration———> pH6.8
Protokol 27 medium slightly changed color after NaOH titration and turned into purpleish.
Then, the mediums are autoclaved.
10/12/2019
Goals:
1)Acetlyation with dry sheets
2)Microscopic pictures
3)Discussion on the smells
1)Acetylation of dried skins (continuation of method 2)
20*7,7=154ml acetic anhydride and 0,63*7,7= 4,851mg iodine are mixed. The solution becomes a little bit yellowish. The skin put inside the solution, heated to 80C degrees for 1 hour, let it cool down. Then saturated sodium thiosulfate solution is added for nautralization and stirred until the skin is colorless. So the color of solution gets darker.
More sodium thiosulfate added then to clean the solution and waited for 1 hour.
Then the skin is rinsed and waited in the 125ml distilled water+ 375ml ethanol solution
De tweede skin (iodine method) is heel perkament-achtig geworden als ze gedroogd is. Ze is precies wel heel sterk geworden (in de zin dat de verschillende lagen echt totaal in mekaar 'versmolten' zijn) maar de oppervlakte voelt eerder 'papier' aan, dan 'leer'. Ik bedoel: er zit totaal geen 'olie-achtig' gevoel meer op de oppervlakte. Maar het is wel mooi. Ik zou dit experiment graag nog eens herhalen op een groter oppervlak skin.
2) Mıcroscopic observations
Spiriluna and synecocystis specimens are prepared to observe under microscope.
Asetlyated skin sample and non-asetylated sKin sample are observed under microscope.
3)Create the 'Smell of the Hive'
We have water based smells——> wax, pollen, propolis, dead bees, honey
How to enhance the water based distillation?
Extraction of hydorosol? Enhance the hydrosol?
How to mix water based and oil based?
To obtain certain smells, we can mixed the most dominant compounds of them.
Aroma profile of our honey:
Warm——> nuts
Fresh——> lemon, ocalyptus, rosemary, lavander, peppermint (lime tree)
Woody——> resines, propolis, turpentine
Chemical——> turpentine, soap
Floral/fruity——> berries, rasberries!
Peppermint——> (acids)heptanoate, (solvents)propyl
Nuts——> benzanoate, propyl
Honey——> phenylacetate, methyl
Mix berries——→ heptanoate, metyl
Rasberries——→ sallicilic acid, butyl
17/12/2019
Observations: We will only work with Synecocystis and Spiriluna
Goals for the day:
a) More medium for Spiriluna will be prepared
b) Beehive odors will be prepared
Methods:
Differrent concentrations of beehive odors are prepared with different ingredients.
They are listed below, from 1 to 7.
1ml wax 1ml propolis 1ml pollen Smell: Like smooth propolis and wax. We could not detect the smell of pollen.
1ml wax 1ml propolis 1ml pollen 0,5ml dead bees Smell: More beehive, more animalistic, more waxy// to nice to and fresh for hive, parfume like
1,5ml wax 1,5ml propolis Smell: More waxy, so fresh for hive
1ml pollen 1ml dead bees 0,5ml wax 0,5ml propolis Smell: Less waxy, more dead bees, nice, more close to beehive odor
0,5ml wax 1ml propolis 1 ml dead bees 1ml pollen Smell: Soft +0,1ml (2 drops) furfurol (vanilla/ almond, synthetic aroma) Smell: Too much aroma +0,5ml wax 1ml propolis Smell: Better
1ml dead bees 1ml pollen 1ml wax
2ml wax 1ml propolis 1ml dead bees 1ml pollen 0,1 cinnamoldeyhyde (synthetic aroma) (almost 2drops) Smell: Too much cinnamon aroma + 0,5ml dead bees 0,5ml propolis 0,5ml wax Smell: Still to much cinnamon + 1ml dead bees 1ml propolis 1ml pollen 1ml wax Smell: Still to much dominant cinnamon
Conlusion: Odor 4 is the closest to beehive. Odor 5 is also in the spectrum.
17/01/2021
prepareren cellen voor tentoonstelling WOVEN BY NATURE
- altijd werken met Agarose Standard (for elektrophorese - Carl Roth) - Art.nr.3810.2
- Phytagel en andere agar agar zijn NIET goed om te werken met Synechocystis
- 1 glazen cel is ong. 300ml van inhoud
⇒ 300ml + 4gr agarose in microwave (meestal 2 x 3 minuten)
⇒ ± 20 min. destilleren in drukketel
⇒ 8 ml alga-grow toevoegen en cellen vullen
⇒ laten afkoelen tot ± 37°C en ± 10ml Synechocystis inspuiten
Rapport Innovatieve Partnerprojecten
Het partnerproject Sensorial Skin was een samenwerking met het Open Biolab van de Erasmus Hogeschool op de Campus Jette. Het project startte in januari 2019 en liep tot eind november 2019.
Het onderzoek start vanuit mijn activiteit als kunstenaar/imker. Reeds meerdere jaren bestudeer ik de ecosystemen van bijenkolonies die overleven in stedelijke omgevingen. In mijn samenwerking met het OpenBiolab onderzoek ik de mogelijkheid om een biosensor te ontwikkelen die omgevingspollutie kan meten in de buurt van de bijenkasten. De sensor bestaat uit een biofilm die gevormd wordt door reeksen vervlochten kettingen van cyanobacteria (die op deze manie een ‘mat’ weven). Ze communiceren onderling en kunnen samen veranderingen in hun omgeving uitdrukken. Wanneer de bacterie-community gestresseerd wordt door het overschrijden van een bepaalde pullutiegraad, communiceren ze dit door van kleur te veranderen en zo een waarschuwing uit te sturen.
Het onderzoek in Het Open BioLab omvatte volgende onderdelen:
In kaart brengen van het ecosysteem in/rond de beehive:
- analyse van de componenten uit de beehive (nectar/propolis/wax/bees/pollen) via distillatie, om zo te komen tot een ‘geur’ die eigen is aan een bepaalde beehive.
‘Strikes’ maken van bepaalde elementen in en rond de bijenkast en deze opkweken in het lab, om op deze manier goedaardige bacteria te isoleren die als symbiont leven binnen het ecosysteem van de bijenkolonie. Deze bacteria zouden kunnen ingezet worden als basis van de biosensor.
Onderzoek naar soorten Cyanobacteria en de formatie van Biofilms:
- opkweken en bestuderen van verschillende soorten cyanobacteria: Synechocystis spp, Spirulina, Oscillatoria, Anabaena. De biofilmformatie en de kettingvorming zijn, naast de quorum sensing (het communicatie mechanisme van bacteria), de elementen die ik gedetailleerd onderzocht heb in experimenten en veel microscopisch onderzoek, en die ik in artistiek werk verwerkt heb.
Een nieuwe installatie die ik gedurende mijn partnership ontwikkelde zal in bioart festivals getoond worden in 2020.
Samenwerkingen met andere organismen:
(Cyano)bacteria die samenleven met korstmossen (lichen) en die zo hun veerkracht kunnen behouden in diverse weersmodellen (koud/warm).
Innovatief Project: Het project 'Sensorial Skin' is gedurfd, innovatief en artistiek. Het daagt uit op verschillende domeinen, zowel in de kunsten als in de wetenschappen en het negeert de tweedeling cultuur/natuur. De verschillende domeinen lopen in mekaar over. Als kunstenaar/imker voer ik artistiek onderzoek dat verder gaat dan de platgetreden paden van het wetenschappelijk onderwerp: ‘de bijensterfte’. In dagen van klimaatverandering en vermindering van biodiversiteit moeten we het onderzoek op een meer speculatieve manier durven voeren, o.a. onderzoek naar nieuwe materialen en (onverwachte) samenwerkingen tussen organismen van verschillende soorten. De bioart heeft -naast zijn artistiek onderzoek- ook een sociale functie te vervullen. In tijden waar de bevolkingsaangroei explosief is moeten burgers andere samenlevingsmodellen met de natuur aangaan om zo het model van ‘groene steden’ vorm te geven. Hier heeft de ‘citizen science’ een belangrijke rol te vervullen. Via het publiek maken van het artistiek onderzoek kan er op een intrigerende en onderzoekende manier gedaan worden aan ‘awareness raising’ educatie. Het project ‘Sensorial Skin’ draagt op zijn manier zeker bij aan deze verandering van ‘mindset’.